La seconda legge della termodinamica è uno dei principi fondamentali della fisica che descrive il comportamento dell’energia e il suo flusso nei sistemi termodinamici. Questa legge ha implicazioni profonde e universali che toccano molti aspetti della scienza e della tecnologia. In termini semplici, la seconda legge afferma che il calore non può spontaneamente fluire da un corpo freddo a un corpo caldo senza l’intervento di un lavoro esterno.
Un concetto chiave della seconda legge della termodinamica è l’entropia, una misura del disordine o della casualità di un sistema. La seconda legge afferma che in un sistema chiuso, l’entropia totale tende a crescere nel tempo, indicando che i processi naturali tendono ad evolversi verso uno stato di massimo disordine.
Matematicamente, questo principio è espresso come: ΔS≥0 dove ΔS rappresenta il cambiamento di entropia. Per processi reversibili, ΔS=0 0, mentre per processi irreversibili ΔS>0.
Esempi Pratici
- Macchine Termiche Le macchine termiche, come i motori a combustione interna, operano trasferendo calore da una sorgente calda a una fredda per produrre lavoro. La seconda legge della termodinamica stabilisce un limite superiore all’efficienza di queste macchine, noto come efficienza di Carnot:
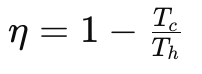
dove η è l’efficienza, Tc è la temperatura della sorgente fredda e Th è la temperatura della sorgente calda. Nessuna macchina termica può essere più efficiente di una macchina di Carnot operante tra le stesse temperature. - Processi Naturali Un esempio quotidiano della seconda legge è il raffreddamento di una tazza di caffè. Il calore fluisce spontaneamente dal caffè caldo all’ambiente più freddo, mai il contrario. Questo aumento di entropia si manifesta nel sistema combinato caffè-ambiente che diventa progressivamente più disordinato.
- Cristallizzazione Durante la cristallizzazione, una soluzione satura di un sale si solidifica formando cristalli, un processo che sembra ridurre l’entropia locale. Tuttavia, l’entropia totale del sistema aumenta perché l’energia rilasciata nella formazione del cristallo aumenta il disordine dell’ambiente circostante.
Conseguenze e Applicazioni
- Principio dell’Irreversibilità La seconda legge implica che alcuni processi sono irreversibili. Una volta che il calore si è trasferito da un corpo caldo a uno freddo, non può tornare indietro spontaneamente. Questo principio è fondamentale nella progettazione di sistemi energetici e nella comprensione dei processi naturali.
- Teoria del Big Bang e la Freccia del Tempo La crescita dell’entropia è anche legata al concetto di freccia del tempo, l’idea che il tempo ha una direzione preferenziale dal passato al futuro. La seconda legge fornisce una spiegazione termodinamica di questa osservazione, suggerendo che l’universo evolve verso stati di entropia crescente.
La seconda legge della termodinamica è una pietra miliare della fisica che descrive la direzione dei processi energetici e la natura del disordine nei sistemi chiusi. Dai motori termici ai processi naturali quotidiani, questa legge fornisce una comprensione profonda del comportamento dell’energia e delle limitazioni fondamentali imposte dalla natura. La sua applicazione attraversa diverse discipline scientifiche, influenzando la nostra comprensione del mondo e guidando l’innovazione tecnologica.


Comments